A Agência Nacional de Vigilância Sanitária (Anvisa) anunciou nesta quinta-feira, 16, a aprovação do uso da vacina da Pfizer contra a Covid-19 em crianças entre 5 e 11 anos. Como o imunizante já tem registro para a doença no Brasil desde fevereiro, a deliberação não passou pela Diretoria Colegiada do órgão, sendo aprovada diretamente pela área técnica da Anvisa. Com a aprovação, a bula da vacina alterada com a indicação de uso para o grupo. Os dados foram submetidos pela Pfizer à Anvisa em 12 de novembro. Em 23 de novembro, a agência enviou exigências técnicas, que foram respondidas pelo laboratório no dia 6 de dezembro. A Anvisa já havia autorizado o uso da vacina para adolescentes de 12 a 16 anos em 11 de junho deste ano.
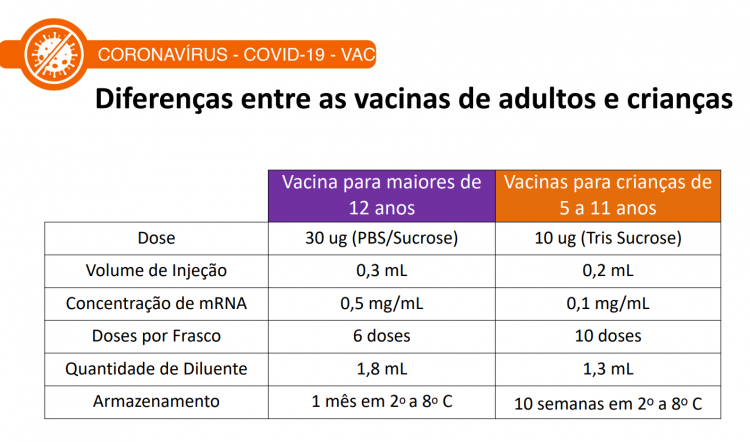
A dose aprovada pela Anvisa para crianças de 5 a 11 anos é menor, de 10ug. O intervalo entre as aplicações é de três semanas. Também haverá diferenças na composição da vacina direcionada a maiores de 12 anos e a que será aplicada em crianças. Os fracos serão diferenciados por cores. Para pessoas de 5 a 11 anos, o frasco será laranja. Para adolescentes e adultos, roxo. O Ministério da Saúde ainda precisará reservar essas doses diferenciadas com o fabricante. Durante a exposição, os diretores da agência informaram que, caso a criança complete 12 anos entre a primeira e a segunda dose, o esquema vacinal deve ser finalizado com a dose pediátrica. Anvisa destaca que há estudos sobre a coadministração com outros imunizantes. Sendo assim, o esquema deve ser homólogo, com as duas doses do mesmo fabricante.
Deu na Jovem Pan